Направление самопроизвольных процессов. Релаксация.
Как следует понимать приведенные здесь результаты?
- Во-первых, понятия температуры не существует без понятия энтропии. Температура появляется исключительно как результат статистического равновесия, иначе мы имеем "суперастрономически" малую вероятность реализации такого состояния в системах, предоставленных самим себе. Эти состояния запрещены не по причине существования законов, их запрещающих, а чисто статистически. Но запрет от этого не становится менее строгим (конечно же, требуется всегда обращать внимание на величину имеющихся флуктуаций). А сам процесс самопроизвольного перехода от менее вероятных (неравновесных) состояний к статистическому равновесию называется релаксацией. Наука, занимающаяся изучением процессов релаксации, называется название кинетикой.
- Во-вторых, температуру ни в коем случае нельзя называть "мерой внутренней энергии" вещества, как это часто ошибочно трактуют, потому что это нарушало бы принцип "бритвы Оккама" ("не создавай сущностей сверх необходимого"), и приводило бы к тяжелым ошибкам на практике. Так если сравнить в обычных условиях величину средней кинетической энергии молекул воздуха (T=300°K или 27°C) со средней кинетической энергией колебательного движения атомов металлического радиатора отопления помещения (батарея отопления), то обнаружится, что средняя колебательная энергия примерно в 3 раза меньше. Однако на практике мы знаем случаи, когда энергия передается от радиатора (от радиатора нагревается воздух), так и противоположные, когда воздух нагревает радиатор (например, летом). При этом колебания температуры в 10-20° на "фоне" 300° никаким образом не могут изменить соотношение средних энергий.
В общем случае неравновесные термодинамические (статистические) состояния сводятся к бинарной задаче: система состоит из двух подсистем, каждая из которых имеет свою температуру. По сути, именно такие системы и являются ансамблями Гиббса. Тогда температура является "указателем", от какой части подсистемы будет передаваться энергия.
Именно на использовании этого процесса релаксации (только и исключительно) может быть построена тепловая машина, способная превратить часть внутренней энергии системы в полезную работу.
Для того чтобы разобраться, какую часть возможно использовать, нам необходимо записать дифференциал внутренней энергии. Он, очевидно, состоит из двух частей - переданной тепловой энергии (системе) и совершенной работы (системой):
dU = dQ-dA, или, исходя из наших знаний, dU=TdS-pdV, где p - давление, dV - дифференциал объема.
Однако, эта формула не совсем полна, хотя для наших целей и вполне достаточна. Дело в том, что мы записали функции распределения для микроканонического и канонического ансамблей, а для большого канонического ансамбля функции распределения выглядят немного иначе:
f(E) = A•e-(E-μ)/kt- классическое распределение Максвелл-Больцмана;
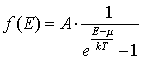 - распределение Бозе-Эйнштейна; - распределение Бозе-Эйнштейна;
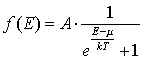 - распределение Ферми-Дирака; где величина μ = dE/dN получила название химического потенциала. Полный дифференциал внутренней энергии тогда примет вид: - распределение Ферми-Дирака; где величина μ = dE/dN получила название химического потенциала. Полный дифференциал внутренней энергии тогда примет вид:
dU = TdS - pdV +mdN.
Роль химического потенциала в рассмотрении различных термодинамических, статистических и кинетических процессов очень велика. Однако в нашем случае классической тепловой машины dN=0, следовательно, химпотенциал также равен нулю.
Циклические процессы. Что такое КПД тепловой машины.
Действие любой тепловой машины всегда сводится к какому-либо циклическому процессу, где рабочее тело циркулирует между "нагревателем" и "холодильником" - теми самыми двумя частями термодинамической системы, имеющими различные температуры. Всегда существует процессы как движения от нагревателя к холодильнику, при котором происходит совершение полезной работы, так и противоположный - движения рабочего тела от холодильника к нагревателю, при котором часть произведенной работы должна быть затрачена. Традиционно такие процессы рисуют на pV-диаграмме, где давление p характеризует силовую компоненту тепловой машины, а объем V - координатную. Это рассмотрение тем более удобно, что его легко можно связать с уравнением состояния рабочего тела (газа).
Для простоты рассмотрения мы будем рассматривать идеальный газ, у которого мы заведомо пренебрегаем размерами молекул (считаем, что длина свободного пробега несравненно больше размеров молекул), а также считаем, что взаимодействия между молекулами происходят только на расстояниях, сравнимых с их размерами. Еще мы будем рассматривать 1 моль идеального газа. Приятые нами допущения позволяют получить все интересующие нас результаты, другие случаи существенно усложняют выкладки, но ни к каким принципиально новым результатам не приводят, за исключением лишь уравнения состояния, чего и следует ожидать.
Итак, на pV-диаграмме любой циклический процесс выглядит как замкнутая кривая - контур, причем обход контура происходит по часовой стрелке (Рис.1). Противоположное направление обхода контура характеризует холодильную машину (то есть холодильник).
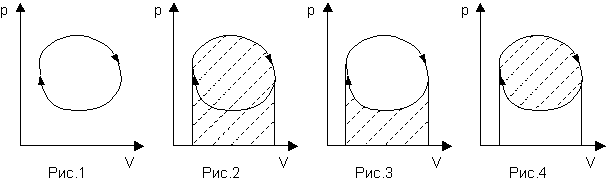
Полная работа, совершаемая рабочим телом, равна заштрихованной площади под кривой, изображенной на Рис.2. Работа, которую требуется совершить, чтобы привести рабочее тело в исходное состояние готовности совершить работу, равна заштрихованной площади на Рис.3. Собственно полная полезная работа, совершенная за цикл, равна заштрихованной области на Рис.4. Коэффициентом полезного действия (КПД) называют отношение заштрихованных площадей на Рис.4 и Рис.2.
К настоящему моменту рассмотрения задачи вполне очевидно, что КПД всегда меньше 100%, но пока непонятно, какова его предельная величина. Может быть, его можно, точно так же, как со скоростью света, бесконечно приближать к 100%? Для ответа на этот вопрос следует ввести понятие теплоемкости и рассмотреть адиабатические процессы.
Теплоемкость. Уравнение адиабаты.
Для начала необходимо напомнить, что в термодинамике часто рассматриваются процессы, происходящие при фиксации одного или нескольких параметров. При этом используются следующие термины: если процессы идут при постоянной температуре, то они называются изотермическими, давлении - изобарическими, объеме - изохорическими, при отсутствии теплообмена (передачи энергии) - адиабатическими.
Нам потребуется еще одно новое понятие - теплоемкость. Совершенно очевидно, что не существует общего понятия теплоемкости - она определяется условиями измерений. Так различают теплоемкость при постоянном объеме - Cvи теплоемкость при постоянном давлении - Cp. Также очевидно, что последняя больше по значению, так как часть энергии уходит на совершение механической работы. Внимательное рассмотрение этой задачи приводит к уравнению
Cp- Cv= R, где R - универсальная газовая постоянная.
Это соотношение носит название уравнения Майера, в честь немецкого врача, впервые его записавшего.
Уравнение адиабаты (частный случай политропических процессов) легко получается из дифференциала внутренней энергии с учетом уравнения Майера и уравнения состояния pV=RT:
dU=TdS-pdV - очевидно, что TdS=0, так как теплообмен отсутствует, тогда
Cv•d(pV)/R = - pdV, откуда dp/p = - Cp•dV/Cv•V.
Это значит, что pVγ=const и есть уравнение адиабаты, где γ = Cp/Cv.
Сами величины теплоемкостей не являются эмпирическими данными и могут быть вычислены, но в рамках кинетического рассмотрения. Но одного приближения идеального газа еще недостаточно, требуется привлечь гипотезу о равнораспределении энергии по степеням свободы. Кинетический ответ очень прост:
CV= N•R/2 , где N - количество степеней свободы.
Для одноатомного газа (например, гелий, неон...) имеется только три координатных поступательных степени свободы, следовательно Cv= 3/2•R. Для двухатомных газов (газ, состоящий из двух молекул, например, азот, кислород...) к трем координатным степеням свободы добавляются две вращательные степени свободы (не три!, так как момент инерции относительно третьей равен нулю), следовательно, Cv= 5/2•R.
Относительно Cpникаких трудностей нет - легко вычисляется при помощи уравнения Майера. Итак, для одноатомных газов показатель адиабатыg=5/3, для двухатомных - 7/5.
Цикл Карно. Предельный КПД тепловой машины.
Сади Карно был еще очень молодым - в возрасте 21 года - когда в начале 19 века придумал (совсем не случайно) цикл, состоящий из двух изотерм (pV=const) и двух адиабат (pVγ=const). Дело в том, что циклический процесс тепловой машины можно изображать не только на pV-диаграмме, а перейти к переменным TS, при этом интегральная техника вычисления КПД по площадям останется неизменной:
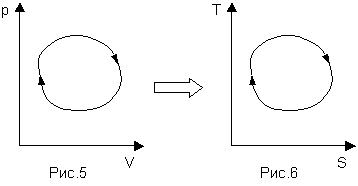
При этом цикл Карно будет выглядеть, как (1,3 - изотермы; 2,4 - адиабаты)

Рассмотрение Рис.8 со всей очевидностью показывает, что площадь, заключенная между TНи TХ, максимальна из всех возможных, то есть для этого цикла КПД = 1-TХ/TНесть предельно возможный КПД тепловой машины. На практике он недостижим (ситуация еще хуже) по очень простой причине: если адиабату можно реализовать высокой скоростью процесса (теплообмен просто не успеет внести какой-либо значимый вклад), то изотермическое расширение и сжатие возможно осуществить лишь за бесконечное время, так как скорость теплообмена (релаксации) должна быть во много раз больше скорости изменения объема, чтобы во время процесса всегда имело место термодинамическое равновесие. Рисунки 7 и 8 составляют суть и являются доказательством теоремы Карно.
Рассмотрение обратного цикла (холодильника) показывает, что получение большей разности температур (в процессе охлаждения) связано со все более низким КПД тепловой машины.
Выводы.
Получение полезной механической работы или полезной энергии во всех видах при использовании тепловой машины возможно только за счет процесса релаксации, приводящего к выравниванию температур нагревателя и холодильника. Самый высокий КПД тепловой машины равен 1-TН/TХи возможен только при использовании цикла Карно, но даже эту величину невозможно получить на практике.
Работа холодильника всегда связана со значительно большими затратами энергии, чем это необходимо для охлаждения рабочего тела. Это означает, что работающий с открытой дверцей бытовой (любой другой также) холодильник неизбежно нагревает воздух в комнате. Очевидно, что энергия, переданная окружающей среде, в точности равна потребленной от внешних источников.
Термодинамические процессы атрономических процессов зачастую намного более сложны и трудны для исследования. И без профессиональной подготовки практически гарантировано приводят к тяжелым ошибкам. Мне, по крайней мере, неизвестно ни одного случая, начиная с 19-го века, когда "философский" или "изобретательский" подход имел бы хоть какой-либо успех.
Автор: С.А.Астахов - физик |



